건국대 의대 유정수 교수팀, 간암 유발 유전자 기전 규명
간암에서 SMARCB1의 과발현으로 핵막단백질 NUP210 인핸서에 크로마틴 구조 변화를 야기하여 비정상적인 발현을 유도시켜 간암 발생 및 유지에 기여하는 기전 규명
서울--(뉴스와이어)--건국대학교 의학전문대학원 유정수 교수 연구팀이 종양억제 유전자로 알려진 ‘SMARCB1’이 간암에서는 종양을 유발할 수 있다는 사실을 최초로 규명했다. 연구팀은 이러한 분자생물학적 기전과 이를 억제할 수 있는 치료전략도 함께 제시했다(논문명: Nucleoporin 210 Serves a Key Scaffold for SMARCB1 in Liver Cancer).
한국연구재단(과학기술정보통신부) 기초연구사업 신진연구자지원사업 지원으로 진행한 이번 연구 성과는 미국 암학회(American Association for Cancer Research)에서 편찬하는 종양학 분야 상위 7.58% 학술지인 ‘Cancer Research(IF 9.727)’에 17일 온라인으로 게재됐다.
간암은 간암의 주요 원인인 B형 간염에 대한 백신과 항바이러스제가 개발되면서 감소를 예상했으나, 여전히 높은 사망률을 기록하고 있다. 특히 40~50대 중년 연령대에서는 전체 암 사망률 1위를 차지하고 있어 사회·경제적 손실이 가장 큰 암으로 꼽히는 암이다.
최근 차세대염기서열분석(NGS: Nest Generation Sequencing)과 같은 기술의 발달과 전 세계 유전체 컨소시엄의 활발한 활동으로 크로마틴 리모델러(ATP를 사용해 염색질인 크로마틴 구조를 변화시키는 단백질 복합체)들의 많은 유전학적 변이와 비정상적인 발현이 많은 암에서 보고되고 있지만, 그 역할과 근본적인 작용 메커니즘은 아직 잘 이해되지 않고 있다(크로마틴 리모델러: 진핵세포의 유전체는 DNA와 히스톤 단백질로 구성된 크로마틴이라는 특수한 구조로 존재한다. 크로마틴 구조의 변화는 유전자 발현과 밀접한 관계를 갖게 되는데, 느슨한 구조는 전사효소들의 결합이 용이 하게 돼 유전자 발현이 잘 되지만, 응축된 구조는 유전자 발현을 억제한다. 세포 내 주된 에너지인 ATP를 이용해 이러한 크로마틴의 구조 변화를 야기하는 단백질 복합체).
유 교수팀은 크로마틴 리모델러의 서브유닛이며 기존에 종양억제유전자로 알려진 SMARCB1이 간암에서 어떠한 역할을 하는지 조사했고, 놀랍게도 SMARCB1은 간암 환자에서 고도로 상향 조절되며 불량한 예후와 관련이 있음을 확인했다.
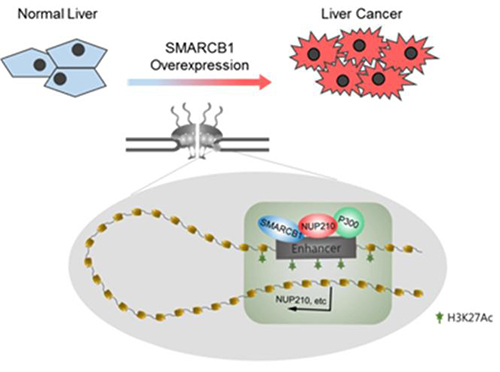
연구팀은 SMARCB1 손실에 따른 유전자 발현과 크로마틴 결합을 기반으로 한 SMARCB1와 H3K27Ac의 포괄적인 분석 결과, 핵막 단백질 NUP210이 간암에서 SMARCB1의 주요 표적임을 밝혔다. SMARCB1이 핵막단백질 NUP210 인핸서(Enhancer, 유전자 발현 DNA 조절 부위)에 결합하면 H3K27Ac의 농축 및 유전자를 발현해 콜레스테롤 항상성과 이종생물대사의 변화를 조절하며, NUP210은 간암에서 새로운 종양 지지체가 될 수 있음을 밝혀냈다. SMARCB1의 과발현은 NUP210 인핸서에 크로마틴 구조 변화를 야기하고, 이는 비정상적인 유전자 발현을 유도해 간암 발생 및 유지에 기여하게 된다.
유정수 교수는 “종양을 억제하는 유전자로 알려진 SMARCB1이 간암에서는 크로마틴 구조 변화를 야기해 간암 발생 및 유지에 기여하는 기전을 규명했다”며 “크로마틴 리모델러 유전적 변이나 비정상적 발현을 가지는 여러 암 치료제 개발에도 활용할 수 있을 것”이라고 말했다.
◇연구해설
SMARCB1의 손실은 생체 내 종양 성장 감소를 포함하는 항 종양 유발 효과를 보였다. 간암에서 많이 발현되고 있는 SMARCB1은 크로마틴 리모델러 SWItch / Sucrose Non-Fermentable(SWI / SNF) 복합 안정성 및 무결성에 기여하는 것으로 보이지만, 기존에 종양억제 유전자로써 알려진 기전인 EZH2와 길항작용, TP53 또는 AMPK 과는 독립적인 기전을 가지고 있었다.
ChIP-seq 및 SMARCB1 손실에 따른 유전자 발현을 기반으로 한 SMARCB1 및 H3K27Ac의 포괄적인 분석 결과 핵막 단백질 NUP210이 간암에서 SMARCB1의 주요 표적임을 밝혔다. SMARCB1이 NUP210 enhancer에 결합하고 H3K27Ac 농축 및 유전자 발현, 특히 콜레스테롤 항상성 및 이종생물대사의 변화를 조절하는 것을 밝혔다.
NUP210이 간암에서 새로운 종양 지지체가 될 수 있고 NUP210이 크로마틴에 대한 SMARCB1 및 P300의 핵심 지지체 단백질 역할을 처음으로 입증했다. SMARCB1 감소시킨 간암 세포에서는 독소루비신 및 P300 억제제에 대한 감수성을 증가시키는 것을 추가로 보여줬다. 종양유전자 SMARCB1의 타깃으로 NUP210을 발굴함으로써 핵막단백질 기능연구 필요성을 제안했다.
이 결과는 크로마틴 리모델러 유전적 변이나 비정상적 발현을 가지는 여러 많은 암에서도 치료제 개발에 활용될 수 있을 것으로 기대된다.